Pokud budeme za konstantního tlaku zahřívat kapalinu, dojde při určité teplotě k jejímu varu. Pod touto teplotou je látka kapalná, za teploty varu je kapalina v rovnováze se svou párou (jejíž tenze právě dosáhla hodnoty vnějšího tlaku), a nad touto teplotou je látka za daného tlaku už pouze v podobě páry (plynné fáze). Můžeme to i otočit - pokud máme látku za vybrané teploty v podobě páry, můžeme ji stlačovat, až bude vnější tlak natolik vysoký, že molekuly plynu spolu začnou interagovat silněji (díky stlačení budou k sobě už dostatečně blízko) a látka zkondenzuje na kapalinu.
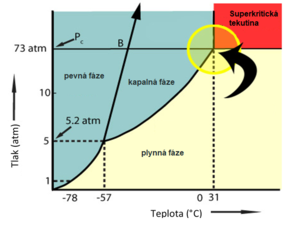
Kritický bod na fázovém diagramu pak ukazuje podmínky, za kterých ještě lze pozorovat zkapalňování plynné fáze. Pokud je látka zahřáta nad kritickou teplotu, tak její pára již nelze za žádného (jakkoliv velkého) tlaku zkapalnit. Hraniční linie je tedy přesně vertikální. Kritický bod má ve fázovém diagramu i odpovídající tlak - za nižšího tlaku je látka v plynné fázi, za vyššího je kondenzovaná v podobě kapaliny. Proto je i následná hraniční linie s rostoucí teplotou zakreslována přesně horizontálně. Při teplotách nad kritickou teplotou a s tlakem vyšším, než je kritický, se pak stírá rozdíl mezi kapalnou a plynnou fází a dramaticky se mění vlastnosti dané látky - zde se mluví o superkritické tekutině (nikoliv kapalině, byť se tak někdy superkritická fáze označuje).
Foto v záhlaví Depositphotos.com