Voda má vzorec H2O, takže její molekula se skládá ze dvou atomů vodíku a jednoho atomu kyslíku. To ví každý, kdo na základní škole v hodinách chemie nehrál karty nebo Minecraft.
Jako správní přírodovědci se ovšem pojďme na vodu podívat trochu podrobněji. Kdybychom měli zázračnou lupu, s níž bychom viděli až dovnitř atomů, zjistili bychom zajímavé věci.
Připomeňme, že každý atom má uprostřed jádro a kolem něj obal tvořený záporně nabitými elektrony. Jádro je pak složené z takzvaných nukleonů – kladně nabitých protonů a nenabitých neutronů.
Všechny atomy jednoho chemického prvku mají stejný počet protonů (a elektronů, které vyrovnávají jejich elektrický náboj). Tak třeba v jádře kyslíku je vždycky 8 protonů.
Ale pozor! Většina prvků vytváří několik izotopů, které se od sebe liší počtem neutronů. Například kyslík, který dýcháme, obsahuje izotopy s 8, 9 nebo 10 neutrony.
Když potřebujeme izotopy některého prvku jednoznačně pojmenovat, aby se nám nepletly, píšeme před chemickou značku vlevo nahoru číslo udávající celkový počet nukleonů v jádře:
16O – kyslík; 8 protonů + 8 neutronů (= 16 nukleonů); 99,76 % kyslíku na Zemi
17O – kyslík; 8 protonů + 9 neutronů (= 17 nukleonů); 0,04 % kyslíku na Zemi
18O – kyslík; 8 protonů + 10 neutronů (= 18 nukleonů); 0,20 % kyslíku na Zemi
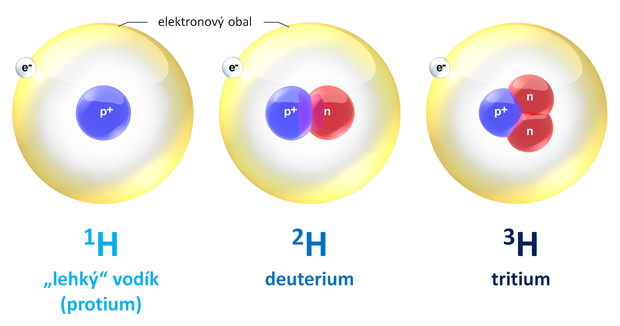
Také vodík má několik izotopů. V přírodě najdeme tři z nich. Mají dokonce své vlastní názvy a chemické značky:
1H – „lehký“ vodík, někdy nazývaný protium; 1 proton; 99,98 % vodíku na Zemi
2H – deuterium, alternativní chemická značka D; 1 proton + 1 neutron; 0,02 % vodíku na Zemi
3H – tritium, alternativní chemická značka T; 1 proton + 2 neutrony; na Zemi ve stopovém množství
„Lehký“ vodík a deuterium jsou stabilní. Tritium je radioaktivní s poločasem rozpadu 12,32 let (za tuto dobu se rozpadne polovina jader ve vzorku).
Naší zázračnou lupou bychom viděli, že v kapce vody drtivě převažují molekuly H216O. Občas bychom ale potkali různé exoty – H218O, D217O, HD16O a další.
Jedním z takových exotů je právě těžká voda. Ta má na rozdíl od obyčejné vody v molekule dva atomy deuteria místo dvou atomů lehkého vodíku. Její chemický vzorec je tedy D2O. Izotopy kyslíku teď nemusíme řešit, stejně se v přírodě vyskytuje skoro výhradně 16O.
Z obyčejné vody, která obsahuje asi jednu molekulu s deuteriem na 3 200 molekul s lehkým vodíkem, se dá různými postupy získat čistá těžká voda. Na první pohled vypadá úplně stejně jako její „lehká“ sestřička H2O. Za pokojové teploty je to čirá kapalina bez barvy, chuti a zápachu. Svými fyzikálními a chemickými vlastnostmi se ovšem poněkud liší.
Příčina je celkem zřejmá. Deuterium má oproti lehkému vodíku v jádře jeden neutron navíc, jeho jádro je tedy zhruba dvakrát těžší. Při dvou atomech deuteria na molekulu to znamená, že molární hmotnost těžké vody je 20,03 gramů na mol – oproti 18,02 g/mol u „lehké“ vody.
Takový rozdíl musí logicky změnit hustotu či jiné fyzikální parametry.
Naopak chemické vlastnosti určuje v první řadě elektronový obal. Lehký vodík i deuterium mají jeden elektron, takže po chemické stránce by se měly chovat stejně.
Vlastnosti elektronů a vazeb v molekulách ale částečně ovlivňuje také hmotnost jádra. Těžká voda se proto i chemicky trochu liší od vody „lehké“.
Shrňme si teď hlavní rozdíly mezi našimi dvěma vodami:
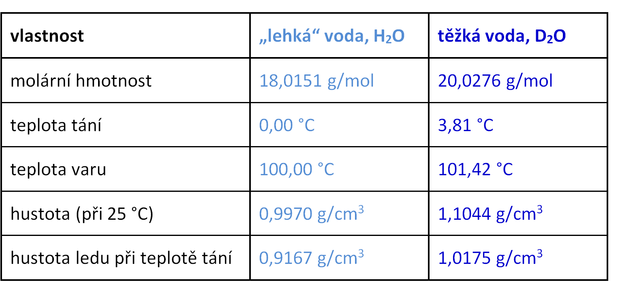
Těžká voda je tedy opravdu těžká. Nejen že obsahuje „těžší“ izotop vodíku, ale může se pochlubit i vyšší hustotou. To platí jak o kapalné vodě, tak o jejím ledu.
Těžký led připravený z D2O taje až při 3,8 °C a při 0 °C má hustotu asi 1,02 g/cm3 – trošku větší, než má za stejné teploty normální kapalná voda. V ledově studené obyčejné vodě díky tomu nastává zvláštní jev. Když do ní hodíte kus těžkého ledu, klesne ke dnu a netaje.
Byl by to skvělý trik na silvestrovskou párty. Ale raději ho nezkoušejte, i kdyby se vám nějak podařilo sehnat těžkou vodu. Je totiž jedovatá, což souvisí s rozdíly v chemických vlastnostech mezi ní a běžnou vodou, kterou pijeme.