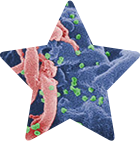
S nechtěnými návštěvníky se lidský organismus potýká odpradávna. Každý vetřelec se ale musel naučit obejít náš imunitní systém. Jak? Stačí mu napodobit cukerné struktury, kterými si tělo chrání vlastní buňky.
Cukerné vizitky a sigleky
Náš imunitní systém má proti rakovině i bakteriálním nákazám vyvinuté důmyslné obranné mechanismy. Aby je ale mohl použít, musí nejdříve poznat, které buňky do těla patří a které už představují hrozbu. K tomu slouží imunitním buňkám sacharidové („cukerné“) struktury na povrchu buněk – něco jako vizitka, která rozhodne, zda buňka projde, nebo bude zničena.
Právě tyto sacharidové „vizitky“ rozpoznávají receptory zvané sigleky, které se nacházejí na povrchu imunitních buněk. Každý z nich má specifickou roli – některé imunitní odpověď aktivují, jiné naopak umí „sešlápnout brzdu“ a odpověď utlumit, aby nedocházelo k útokům proti vlastním buňkám. Společné ale sigleky mají jedno: všechny rozpoznávají kyselinu sialovou, drobnou devítiuhlíkatou molekulu, která často zdobí povrchové proteiny našich buněk a slouží jako klíčový komunikační signál.
Jak vetřelci klamou imunitu?
Za normálních okolností tento systém pomáhá imunitě odlišovat „vlastní“ od „cizího“. Jenže evoluce je vynalézavá – a některé nádory (například melanom nebo rakovina slinivky) i patogeny (bakterie Neisseria meningitidis, Streptococcus skupiny B či viry HIV-1, Ebola nebo v posledních letech všem známý SARS-CoV-2) dokáží tuto strategii zneužít. Povrch svých buněk a obálek totiž převlečou za naše vlastní buňky, napodobí jejich cukerné struktury a tím se před imunitními buňkami skryjí.
Významným hráčem v tomto procesu je receptor Siglec-7, který se nachází na tzv. NK buňkách (natural killer cells). Tito „přirození zabijáci“ dokáží rychle likvidovat nádorové nebo virem infikované buňky. Pokud však Siglec-7 rozpozná sialované struktury, vyšle do NK buňky signál „neútočit“ – a tím může nádor či patogen získat výhodu.
Český příspěvek k výzkumu
Klíčovým předpokladem pro detailní výzkum těchto mechanismů byla práce týmu RNDr. Ondřeje Vaňka, Ph.D. na Přírodovědecké fakultě UK. Vědci připravili a charakterizovali hned několik variant extracelulární části receptoru Siglec-7, popsali jeho stabilní dimerizaci a vyvinuli metodiku, která umožnila produkci dvojitě izotopově značeného proteinu (¹³C/¹⁵N) v savčích buňkách. Díky tomu se otevřela možnost studovat Siglec-7 pomocí nukleární magnetické rezonance (NMR) v detailu, jaký byl dosud nedostupný. Právě tyto rekombinantní proteiny připravené na PřF UK pak sehrály zásadní roli v dalších mezinárodních studiích, které zkoumaly, jak receptor Siglec-7 rozpoznává nádorové gangliosidy nebo kapsulární polysacharidy patogenních bakterií.
GD3: falešná vstupenka nádorů
Siglec-7 se zaměřuje na cukerné struktury gangliosidů, což jsou glykolipidy hojně zastoupené v nervové soustavě. Zvláštní pozornost si ale získal gangliosid GD3, který je často nadměrně produkován v nádorových buňkách. Tento glykolipid se váže přímo na Siglec‑7 na NK buňkách, spouští inhibiční signál a nádor tak získává ochranu před zabitím. Díky kombinaci moderních metod – NMR, fluorescenčních testů a počítačového modelování – se vědcům podařilo popsat molekulární detaily vazby Siglec-7 právě s gangliosidem GD3.
Studie ukázala, že vazba gangliosidů k Siglec-7 je zajištěna především aminokyselinou arginin v pozici 124, která vytváří stabilní kontakt se sialovou kyselinou. Důležité jsou také konformační rozdíly mezi jednotlivými gangliosidy – tedy to, jak jsou cukerné části prostorově uspořádány. Ty mohou zásadně rozhodnout o tom, zda Siglec-7 strukturu rozpozná a vyšle brzdící signál. Tím se potvrzuje role Siglec-7 jako glyko-imunitního kontrolního bodu (tzv. checkpointu), který nádorové buňky dokáží využít k utlumení cytotoxické reakce NK buněk. Detailní znalost struktury těchto interakcí otevírá cestu k novým možnostem imunoterapie – od protilátek přes vakcíny až po malé molekuly cíleně blokující osu Siglec-7–gangliosidy.
Bakterie v cukernatém brnění a cesta k novým terapiím
Na výsledky týmu dr. Vaňka navazují ve spolupráci i další nedávné studie, zaměřující se na roli receptoru Siglec‑7 v interakci s povrchovými sialovanými sacharidy patogenních bakterií jako je Neisseria meningitidis, původce meningitidy, či Fusobacterium nucleatum, bakterie zcela běžná nejen v naší dutině ústní, avšak bohužel i v celé řadě nádorů, např. u kolorektálního karcinomu. I zde se ukázalo, že Siglec‑7 hraje roli „molekulární brzdy“ imunity. Poznatky z těchto studií nejen odhalují sofistikované strategie, jakými se patogeny a nádory brání imunitnímu útoku, ale také otevírají cestu k novým formám nádorové imunoterapie – například blokováním vazby Siglec-7, aby tělo opět rozpoznalo „nepřítele“.